 導航
導航

來源:生物世界
企鵝號
隨著科技進步和醫學發展,許多過去讓人們束手無策的疾病如今都逐一被緩解,甚至徹底治愈。然而,癌癥——作為“眾病之王”,卻仿佛一道難以攻克的天塹,至今仍未完全被人類所戰勝。
從傳統的癌癥治療方法,如放療和化療,再到如今新興的腫瘤治療方法——靶向藥物、溶瘤病毒以及免疫治療,科學的進步為腫瘤患者帶來了新的希望,但遺憾的是,這些方法并不能徹底解決癌癥這一難題。
因此,這也迫使人類不斷開發更新、更高效的癌癥治療方法!
2020年11月18日,以色列特拉維夫大學的研究人員在Science子刊Science Advances雜志上發表題為:CRISPR-Cas9 genome editing using targeted lipid nanoparticles for cancer therapy 的研究論文。
這項研究為世界首例證實CRISPR/Cas9系統可以有效治療活體動物轉移性癌癥的研究。
研究人員開發了一種新的基于脂質納米顆粒(LNP)的CIRSPR遞送系統——CRISPR-LNP,并在兩種侵襲性和不可治愈的癌癥類型——膠質母細胞瘤和卵巢癌中表現出良好的治療效果。

CRISPR技術的迅速發展正在潛移默化地改變著生命科學研究領域乃至人類世界。目前,CRISPR技術已經廣泛應用于基因編輯、基因治療、核酸定位及核酸檢測等領域。
2020年10月7日,兩位在CRISPR基因編輯領域做出杰出貢獻的科學家——Emmanuelle Charpentier和Jennifer A. Doudna更是被授予了2020年諾貝爾化學獎。
近年來,分子靶向藥物和免疫治療等的興起極大地改善了癌癥反應,降低了藥物毒性和不想反應。然而,大多數類型癌癥的高復發率和耐藥性的發展促使我們不斷開發新的治療方式。
值得注意的是,CRISPR-Cas9基因編輯技術從原理上可以永久破壞腫瘤生存基因,從而克服傳統癌癥療法的重復劑量限制,提高治療效果。
但遺憾的是,CRISPR-Cas9技術用于癌癥治療一直受到腫瘤細胞編輯效率低和現有遞送系統潛在毒性的阻礙。
在這項研究中,研究團隊報道了用于治療性基因組編輯的靶向非病毒脂質納米顆粒(LNP)遞送系統的開發,并在膠質母細胞瘤和卵巢癌這兩種侵襲性和不可治愈的癌癥模型中對其進行了評估。
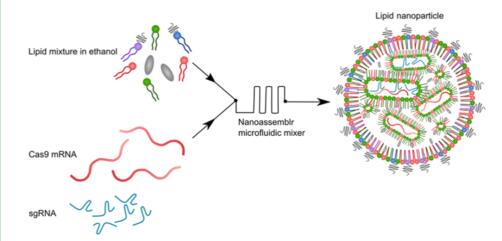
CRISPR-LNP的設計與構建
該研究得通訊作者Dan Peer教授表示,這是世界上第一個證明CRISPR基因組編輯系統可以在活體動物身上有效治療癌癥的研究,必須強調的是,這不是化療,沒有副作用,并且用這種方法治療的癌細胞將永遠不會再活躍起來。Cas9的分子剪刀切斷癌細胞的DNA,從而去除它,永久阻止癌細胞復制。
為了確定這項技術在治療癌癥上的可行性,Dan Peer教授及其研究團隊選擇了兩種最致命的癌癥——膠質母細胞瘤和轉移性卵巢癌。
膠質母細胞瘤是一種侵襲性最強的腦癌,診斷后預期壽命為15個月,5年生存率僅為3%。研究人員證明,僅用CRISPR-LNP進行一次腦內注射治療,就可以使患有膠質母細胞瘤的小鼠的平均壽命增加一倍,抑制腫瘤生長50%,提高生存率30%!
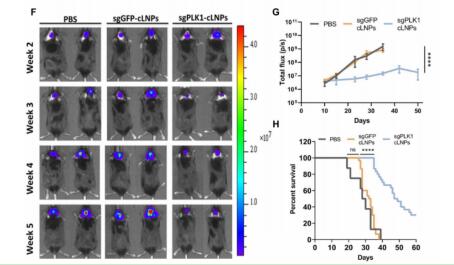
CRISPR-LNP對小鼠腦內的膠質母細胞瘤有良好的治療效果
與此同時,卵巢癌是女性疾病死亡的重要原因,也是女性生殖系統中最致命的癌癥。大多數患者確診時已是卵巢癌晚期,此時癌細胞已經擴散到全身。盡管近年來取得了進展,但也僅有三分之一的患者能活下來。
為了治療擴散性卵巢癌,CRISPR-LNP也被研究團隊設計用于抗體靶向遞送,腹腔注射EGFR靶向的CRISPR-LNP可選擇性攝取到播散性卵巢腫瘤,體內可進行高達80%的基因編輯,抑制腫瘤生長,并提高小鼠80%的總生存率!
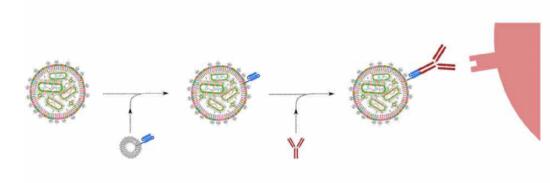
抗體靶向遞送的CRISPR-LNP設計原理圖
CRISPR基因編輯技術,能夠識別和改變幾乎任何基因片段,已經徹底改變了我們以個性化的方式破壞、修復甚至替換基因的能力,盡管CRISPR在研究中得到了廣泛應用,但臨床應用仍處于起步階段,因為需要一個有效的傳遞系統來安全、準確地將CRISPR傳遞到靶細胞。
而該研究中開發的CRISPR-LNP遞送系統,可以高效靶向腫瘤生存基因,這是一種創新療法,用于治療目前一些尚無有效療法的惡性腫瘤。
值得一提的是,將CRISPR基因編輯技術應用于癌癥治療,并非Dan Peer團隊的“一家之言”,例如2020年3月9日,武漢大學程巳雪團隊就在國際著名期刊Advanced Materials雜志(IF=25.809)發表了題為:Aptamer/Peptide-Functionalized Genome-Editing System for Effective Immune Restoration through Reversal of PD-L1-Mediated Cancer Immunosuppression 的研究論文。
該研究開發了一種基于天然聚合物的基因治療遞送系統,能夠將CRISPR-Cas9基因編輯質粒特異性遞送至腫瘤細胞核,進而敲除β-catenin,下調腫瘤細胞上PD-L1表達,逆轉PD-L1介導的腫瘤免疫逃逸,增強T細胞對腫瘤的殺傷力!

總而言之,本研究基于CRISPR基因編輯技術和脂質納米顆粒(LNP)開發的聯合系統——CRISPR-LNP在治療膠質母細胞瘤和轉移性卵巢癌小鼠模型上展示出驚人的潛力。更重要的是,這項技術具有廣闊的應用前景,它將為治療其他類型的癌癥、罕見的遺傳疾病和慢性病毒疾病(如艾滋病)開辟了無數新的可能性。
據悉,Dan Peer教授團隊現在計劃繼續對血液類癌癥以及杜氏肌萎縮癥等遺傳疾病進行相關實驗,Dan Peer教授表示,這種創新療法可能還需要一段時間才能用于人類,但對此持樂觀態度。正如12年前,當我們第一次談到基于mRNA的治療時,人們還以為這是科幻小說。
論文鏈接:
https://advances.sciencemag.org/content/6/47/eabc9450
https://doi.org/10.1002/adma.202000208
免責聲明:本文來自騰訊新聞客戶端自媒體,不代表美侖生物的觀點和立場。




 全國客戶服務電話
0411-62910999
全國客戶服務電話
0411-62910999



